|
метод ГРВ профессора К.Г. Короткова |
|||||||||
|---|---|---|---|---|---|---|---|---|---|
Свиридов Л.П. * , Степанов А.В. * , Комиссаров Н.В. * , Ахметели Г.Г. ** , Короткина С.А. ** , Лобкова О.С. *** , Лобкова Ю.С. ***
ПРИМЕНЕНИЕ МЕТОДА ГРВ ДЛЯ этиологической диагностики аллергий
*НИИЦ (МБЗ) ГНИИИВМ МО РФ,** НОА «КТИ»,*** ВМедА
В настоящее время отмечается неуклонный рост числа аллергических заболеваний, которыми страдает до четверти населения. При этом диагностике придается приоритетное значение. В этом процессе примат принадлежит лабораторным методам выявления сенсибилизирующих агентов, так как даже тщательно собранный анамнез заболевания позволяет лишь предположительно определить заинтересованный (сенсибилизирующий) фактор [1].
В настоящее время различают 4 типа аллергических реакций. В патогенезе трех из них, объединенных в группу гуморальных (типы I-III), ведущее место принадлежит антителам, а одного (тип IV ) – сенсибилизированным иммунокомпетентным клеткам. Это деление весьма условно, поскольку нередко происходит одновременное развитие реакций нескольких типов: при анафилаксии срабатывают механизмы I и I I I типов, при аутоиммунных заболеваниях – III и IV типов, при лекарственной аллергии – все четыре типа [1, 2].
Несмотря на многочисленные исследования, связанные с усовершенствованием методов определения типа аллергии и, что особенно важно, конкретной природы ее причинно-значимого фактора, диагностика этих состояний пока не в полной мере отвечает предъявляемым к ней требованиям. До сих пор в практике используют методы, которые выявляют аллергопатологию лишь в отдельных звеньях иммунной системы и не позволяют судить о всей гамме разворачивающихся событий, что, безусловно, снижает их эффективность и информативность; они нередко дают ложноположительные или отрицательные результаты даже при наличии весьма убедительных признаков заболевания.
Что касается инвазивных проб (кожных, провакационных), то, несмотря на их достаточно высокую информативность, они характеризуются высокой реактогенностью и требуют большой осторожности, так как могут вызывать осложнения местного и системного характера и провоцировать весьма нежелательное обострение процесса [1].
В этой ситуации, как представляется, необходимы методы, позволяющие устанавливать этиологию аллергии путем интегральной оценки реакции иммунной системы конкретного индивидуума на определенный аллерген. С этих позиций наше внимание привлек метод газоразрядной визуализации (ГРВ), который фиксирует сдвиги физико-химических характеристик жидкостей, в том числе и биологических, представляя объективную информацию в виде кривых на дисплее компьютера [3].
Целью исследования являлось клинико-экспериментальное обоснование пригодности ГРВ-метода для этиологической диагностики аллергии. Для ее реализации были поставлены следующие задачи:
• Изучить способность ГРВ-метода фиксировать наличие в биологической жидкости медиаторов взаимодействия иммунокомпетентных клеток и аллергена, а также реакции антиген/антитело, то есть реакции агглютинации;
• Оценить ГРВ в эксперименте на животных как метод определения аллергического статуса;
• Проверить данные эксперимента (при получении положительных результатов) на людях, страдающих аллергией.
Материалы и методы
В качестве медиаторов использовали лиофильно высушенные гистамин, серотонин и адреналин. Для получения реакции агглютнации применили вакцинный штамм туляремийного микроба, B. fragilis и специфические антитела к ним.
В эксперименте аллергию моделировали на морских свинках по общепринятой методике: вводили однократно внутрибрюшинно 0,1 мл нормальной лошадиной сыворотки (ЛС), что способствовало формированию у них через 3-4 недели повышенной чувствительности к белкам, содержащимся в ЛС [4].
Для детекции аллергии применяли следующую схему анализа. Гепаринизированную кровь каждого обследуемого животного разливали по 0,5 мл в шесть центрифужных пробирок. Затем в три из них (опытные) вносили по 0,2 мл ЛС, в три другие (контрольные) – по 0,2 мл сыворотки крупного рогатого скота (СРС), к которой повышенная чувствительность у морских свинок априори отсутствовала. Плазму крови двух проб (одной опытной и одной контрольной), полученную путем центрифугирования (1500 об/мин в течение 3 мин), исследовали сразу же после смешивания указанных компонентов, двух – после их инкубации в течение 1,5 ч при 37 0 С (в термостате), двух – через сутки (1,5 ч – в термостате, а затем при комнатной температуре). При этом мы полагали, что появление в крови животных иммунных комплексов и медиаторов в результате повторного взаимодействия в пробирке аллергена со специфическими антителами и сенсибилизированными к нему клетками повлечет изменение эмиссионных свойств плазмы экспонированной 1,5 и 24 ч крови, по сравнению с исходной (первой) пробой, что может быть выявлено с помощью ГРВ-графии.
Кроме того, было обследовано 5 человек с пищевой аллергией, которые находились под наблюдением специалистов-аллергологов кафедры военно-полевой терапии Военно-медицинской академии. В отличие от экспериментальной части работы у больных исследовали с помощью ГРВ-метода не только сыворотку крови, но и кровь.
Результаты
Как известно, участниками развертывающихся в организме аллергических реакций являются медиаторы. В связи с этим считали необходимым предварительно, до исследований на животных, выяснить, можно ли их обнаружить с помощью ГРВ-метода в такой сложной и многокомпонентной биологической среде, какой является кровь. С этой целью исследовали пробы ЛС, в которые вносили или гистамин, или серотонин, или адреналин в концентрации 200 мкг/мл. Было установлено, что сыворотка без медиаторов (контроль) по ГРВ-граммам достоверно отличалась от опытных проб. Об этом, в частности, свидетельствовали такие показатели, как площадь и средняя интенсивность свечения.
В основе гуморальных механизмов развития аллергических реакций лежит взаимодействие аллергена с комплементарными к нему антителами. Поэтому в специальных опытах была оценена способность изучаемого метода фиксировать реакцию агглютинации. Оказалось, что ГРВ выявляет и эти иммунные комплексы, образующиеся в результате специфических иммунных реакций между антигеном и соответствующим ему антителом (в нашем случае – реакцию между вакцинным штаммом туляремийного микроба, B. fragilis и комплементарными к ним антителами).
Полученные результаты позволили перейти к опытам на морских свинках, у которых моделировали аллергию к чужеродному белку – к нормальной лошадиной сыворотке.
В соответствии с избранной нами схемой постановки реакции первые две пробы, исследованные сразу после смешивания реагирующих компонентов, предназначены для оценки исходного состояния плазмы крови, а последующие – для выявления изменений, которые могли произойти в результате последующего контакта крови с чужеродной сывороткой (с ЛС или СРС).
При этом мы полагали, что при такой схеме анализа кровь аллергизированных животных будет различным образом реагировать на вызвавший аллергизацию антиген, то есть аллерген (ЛС), и гетерологичный (контрольный) антиген (СРС). При контакте с аллергеном в течение 1,5 ч сенсибилизированные клетки будут активнее синтезировать и секретировать биологически активные факторы взаимодействия, а при их распаде может происходить выход цитоплазмы в жидкую часть крови. На контрольный антиген (СРС) реакция клеток крови тех же животных, вероятно, может быть менее активной по сравнению с ее выраженностью на аллерген.
Через 24 ч должна происходить и реакция агглютинации аллергена со специфическими к нему антителами, в то время как в контрольной пробе (кровь + СРС) она будет отсутствовать.
Указанные отличия в реакции крови опытных животных на аллерген и гетерологичный антиген мы рассчитывали выявить с помощью ГРВ-метода.
В результате исследования оказалось, что кровь большинства (88 %) сенсибилизированных животных весьма активно реагировала на причинно-значимый аллерген: ГРВ-граммы плазмы, полученной из крови, которая в течение 1,5 ч или 24 ч контактировала в пробирке с ЛС, достоверно отличались от исходных линий, характеризующих эмиссионные свойства плазмы, полученной сразу после смешивания крови и аллергена, т.е. до их взаимодействия. В качестве примера приводим ГРВ-граммы одной из свинок, об аллергизации которой свидетельствовали такие показатели как площадь свечения плазмы, средний радиус изолинии , нормализованное СКО радиуса изолинии, коэффициент формы. В отличие от этого, реакция крови той же морской свинки на гетерологичный антиген (СРС) была существенно менее выраженной.
Такие отличия мы наблюдали у 8 животных из 9 обследованных (табл. 1). Положительным результатом считали, когда:
- реакция на ЛС имелась по одному или нескольким показателям, а на СРС она отсутствовала вовсе (животные №№ 1, 2, 4, 8, 9);
- реакция на ЛС выявлялась по большему числу критериев, чем на СРС (животные №№ 3, 5, 7).
При таком подходе как отрицательный (отсутствие аллергии к ЛС) мы расценивали результат обследования морской свинки № 6: на ЛС имелись достоверные различия лишь по одному показателю – коэффициенту формы, а на СРС – по двум – среднему радиусу изолинии и средней интенсивности.
Особо следует отметить, что в 70 % случаев положительный ответ мы получали при исследовании крови после ее экспозиции в термостате в течение 1,5 ч. Это свидетельствует об экспрессности метода ГРВ, что выгодно его отличает от используемых в настоящее время.
На заключительном этапе работы изучаемый метод был апробирован на людях, личный аллергологический анамнез которых указывал на наличие у них пищевой аллергии к белку куриного яйца. При этом исследовали не только сыворотку крови, но и саму кровь. В качестве контроля служили пробы исследуемого материала с разводящей жидкостью и причинно незначимым аллергеном – домашней пылью, мясом утки.
Результат исследования считали положительным в том случае, если:
• ГРВ-грамма экспонированной в течение 90 мин. пробы крови с подозреваемым аллергеном (по данным анамнеза) достоверно отличалась от аналогичной кривой, получаемой при анализе проб с разводящей жидкостью и контрольными (гетерологичными) аллергенами (критерий А);
• ГРВ-грамма исходной пробы крови с подозреваемым аллергеном достоверно отличалась от аналогичной кривой, получаемой при исследовании экспонированной пробы, при отсутствии такой временной динамики в пробах с разводящей жидкостью и контрольными антигенами (критерий Б).
Для подтверждения информативности и достоверности изучаемого метода в каждом конкретном случае данные ГРВ-грамм сопоставляли с результатами, получаемыми с помощью такого общепринятого теста как реакция торможения миграции лейкоцитов (РТМЛ).
В итоге, у трех пациентов из пяти обследованных обоими методами было установлено наличие аллергии, обусловленной белком куриного яйца, у двух – аллергия исключена.
Для демонстрации представляем ГРВ-граммы больного А., аллергологический анамнез которого давал основание предполагать, что аллергия у него обусловлена белком куриного яйца. Поэтому при исследовании крови препарат этого белка был «опытным», а контролями служили разводящая жидкость и домашняя пыль. В результате графически была установлена различная выраженность реакции крови на этиологически значимый аллерген, гетерогенный антиген и разводящую жидкость.
Так, при оценке по критерию А оказалось, что реакция крови на домашнюю пыль через 90 мин. экспозиции была такой же, как и на разводящую жидкость, что указывало на отсутствие у пациента сенсибилизации к этой субстанции. В то же время кривая, отображающая физико-химические свойства крови после взаимодействия ее компонентов с белком куриного яйца, имела достоверно иное пространственное расположение по отношению к контрольным линиям, косвенно указывая на повышенную чувствительность (аллергию) больного к этому чужеродному белку.
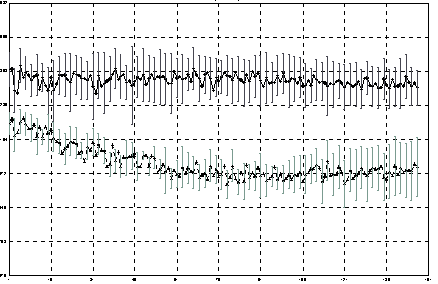
Об этом свидетельствовал и критерий Б. Пробы крови, в которые были внесены разводящая жидкость или домашняя пыль, имели одинаковую физико-химическую характеристику как при первом, так и при втором (после экспозиции) исследовании, т.е. реакция компонентов крови отсутствовала. Иная реакция крови была на белок куриного яйца: ГРВ-граммы, полученные до взаимодействия крови с белком (экспозиция 0 мин.) и после (экспозиция 90 мин.), достоверно отличались между собой (Рис. 1), что являлось несомненным показателем изменения эмиссионных свойств крови и, следовательно, сенсибилизации больного именно этим белком.
Безусловно, столь ограниченные клинико-лабораторные наблюдения на людях не позволяют сделать какие-либо окончательные обобщения. Для этого необходимо продолжение начатой работы по обследованию больных аллергией людей для формулирования рекомендаций по применению ГРВ-метода в аллергологии.

Тем не менее, как экспериментальные данные, так и результаты исследований на людях, представленные в данном сообщении, можно рассматривать как довольно весомое свидетельство перспективности нового предназначения ГРВ-метода, связанного с детекцией конкретной причины аллергии у людей.
Рис.1. Площадь ГРВ-грамм образцов крови до взаимодействия крови с белком (экспозиция 0 мин. – верхняя кривая) и после (экспозиция 90 мин. – нижняя кривая).
• Общая аллергология. Под ред. Федосеева Г.Б. Санкт-Петербург, 2001, 815 с.
• Клиническая иммунология. Под ред. Караулова А.В. М., 1999, 604 с.
• Коротков К.Г. Основы ГРВ биоэлектрографии. Санкт-Петербург, 2001, 360 с.
• Аллергия в клинике и эксперименте. Под ред. Федорова А.В. Киев, 1968, 150с.
|
|
|---|